阈值能17 Mar 2025 | 6 分钟阅读 阈值能量是一个在物理学和化学中经常使用的概念,用于描述特定过程发生所需的最小能量。它指的是启动特定反应所需的能量水平,例如键的断裂或原子的激发。 在量子力学中,粒子穿过壁垒或势能阱所需的最小能量称为阈值能量。它与活化能密切相关,活化能是指化学反应发生所需的最小能量。然而,阈值能量指的是启动反应所需的能量,而活化能则特指达到过程的过渡态所需的能量。 在光化学(光与物质的相互作用)研究中,阈值能量的概念起着至关重要的作用。在光化学中,启动光化学反应所需的最低能量称为阈值能量。当分子吸收光时,光能可用于断裂化学键、激发电子或启动其他化学事件。然而,并非所有波长的光都具有启动反应的足够能量。只有能量高于分子阈值能量的光波长才能启动反应。 阈值能量的概念在核物理学研究中也很重要。在核反应中,阈值能量是指特定反应发生所需的最小能量。该能量取决于反应中核的质量以及核的能量状态。在某些情况下,核反应的阈值能量可能非常高,通过常规方法可能难以达到所需的能量水平。这正是核反应通常使用高能粒子加速器进行研究的原因之一。 在化学中,"阈值能量"一词经常用于描述断键过程。当两个原子结合在一起时,需要一定的能量来将它们固定在一起。分子需要获得一定的能量才能断开这种联系。阈值能量受键的强度和涉及原子的特性这两个因素的影响。与碳和氧等较重原子之间的键相比,氢和氧等较轻原子之间的键的阈值能量较低。 阈值能量的类型阈值能量是启动特定过程或反应所需的最小能量。它在科学和技术的各个领域都起着至关重要的作用。阈值能量的一些重要用途包括:
阈值能量的计算阈值能量是启动特定反应或过程所需的最小能量。换句话说,它是断开反应物之间的键并启动化学反应所需的能量。阈值能量的计算是理解反应动力学和设计实验对其进行研究的关键步骤。 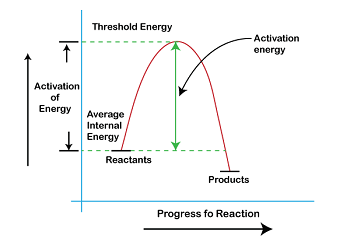 反应的阈值能量可以通过多种方法计算,包括计算方法和实验方法。方法的选择取决于具体反应和可用资源。 计算阈值能量的一种常用方法是阿伦尼乌斯方程。阿伦尼乌斯方程将化学反应的速率常数与活化能、温度和频率因子联系起来。活化能是启动反应所需的最小能量,而频率因子衡量反应物碰撞以克服活化能的频率。 阿伦尼乌斯方程为 k = Ae(-Ea/RT) 其中 k 是速率常数,A 是频率因子,Ea 是活化能,R 是气体常数,T 是温度。 为了计算活化能,我们可以重新排列方程如下: ln(k/T) = ln(A) - (Ea/RT) 通过绘制 ln(k/T) 对 1/T 的图,可以由活化能和由此产生的直线的斜率确定。这种方法称为阿伦尼乌斯图。 计算阈值能量的另一种方法是通过过渡态理论。过渡态理论是理解化学反应的框架,其中涉及过渡态的概念,过渡态是反应物和产物之间存在的高能中间态。 在过渡态理论中,反应速率与过渡态中反应物的浓度成正比。过渡态的浓度可以使用玻尔兹曼分布计算,该分布将过渡态的能量与其存在的概率联系起来。 玻尔兹曼分布为 P(E) = (1/Z) * e^(-E/kT) 其中 P(E) 是过渡态具有能量 E 的概率,Z 是配分函数,k 是玻尔兹曼常数,T 是温度。 配分函数是衡量能量在系统中粒子之间分配方式的量度。它由以下公式给出: Z = ∫ e^(-E/kT) dE 其中积分是在所有可能的能量上进行的。 可以通过确定过渡态的能量和配分函数来使用过渡态理论计算阈值能量。这种方法对于涉及大分子或复杂反应机理的反应特别有用。 确定阈值能量的实验方法包括温度依赖性研究和动力学同位素效应研究。温度依赖性研究涉及在不同温度下测量反应速率,并使用阿伦尼乌斯方程计算活化能。动力学同位素效应研究涉及比较相同元素不同同位素的反应速率,并使用速率差异来计算活化能。 结论总之,阈值能量的计算是理解化学反应动力学的关键步骤。有几种方法可用于计算阈值能量,包括阿伦尼乌斯方程和过渡态理论等计算方法,以及温度依赖性研究和动力学同位素效应研究等实验方法。方法的选择取决于具体反应和可用资源。 下一个主题安培单位 |
我们请求您订阅我们的新闻通讯以获取最新更新。