元素化合价或氧化态的周期性2025年3月17日 | 阅读 12 分钟 化合价“化合价”一词描述了元素的原子或离子的原子或离子与其他原子或离子形成化学键的数量。原子的“价”是它的另一个名称。 换句话说,一个元素的化合价是由其原子最外层电子数决定的,最外层电子也称为价电子层。 价电子层中可用于与其他原子或离子形成键的价电子数决定了元素的化合价。价电子是参与化学反应并位于价电子层中的电子。 例如,一个氧原子的化合价是2,因为它的最外层有6个电子,但需要8个电子才能形成稳定的八隅体结构。因此,为了完成其八隅体,它必须获得2个电子,这可以通过与其它原子形成2个共价键来实现。 元素的化合价用于预测由不同元素组合形成的化合物的化学式,并且是决定其与其它元素发生化学反应的关键因素。 化合价的类型1. 负电荷化合价 原子达到稳定电子构型所需的电子数量称为其负电荷化合价。由于氧需要两个额外的电子才能完成其外层并达到稳定,因此它的负电荷化合价为2。 2. 正电荷化合价 原子能够失去以形成正离子的电子数量称为其正电荷化合价。由于钠可以失去一个电子形成Na+离子,因此它的正电荷化合价为1。 3. 共价化合价 一个原子可以与另一个原子共享以形成共价键的电子数量称为共价价。例如,由于碳可以与其它原子交换四个电子,因此它的共价化合价为四。 4. 配位化合价 在复合物中,可以围绕主金属离子配位的原子或离子数量称为配位价。例如,在像[Fe(CN)6]4-这样的复合离子中,铁的配位化合价为6,因为它可以与六个氰离子结合。 5. 氧化化合价 “氧化化合价”一词描述了原子在化学反应中可以获得或失去的电子数量。例如,在Fe2+中,铁的氧化化合价为+2,因为失去了两个电子;在FeO中,铁的氧化化合价为-2,因为获得了两个电子。  氧化态氧化态,也称为氧化数,是衡量化学物质中原子被氧化的程度。它是预测元素和化合物化学行为的有效工具,对化学的许多分支至关重要,例如氧化还原反应、电化学和配位化学。 通常,原子的氧化态是指与其中性、未结合形式相比,原子在化学反应中获得或失去的电子数量。当原子获得电子时,它被还原并具有较低的氧化态,而当它失去电子时,它被氧化并具有较高的氧化态。 德国化学家弗里德里希·沃勒在19世纪中叶引入了氧化态的概念。从那时起,许多化学家和学者改进并扩展了这一概念。它现在是化学中的一个基石概念,经常用于理论和实验研究。 钠和氯反应生成氯化钠(食盐)是最基本的氧化态实例之一。在此反应中,氯获得一个电子形成带负电荷的离子,而钠失去一个电子形成带正电荷的离子(Na+)(Cl-)。在此分子中,钠的氧化态为+1,而氯的氧化态为-1。 确定更复杂化合物中每个元素的氧化态可能更困难。氧化态规则是一组可用于确定化合物中每个元素的氧化态的准则和规则。这些定律基于对各种元素及其在化学反应中获得或失去电子倾向的理解行为。 中性化合物中所有原子的氧化态之和为零的要求是分配氧化态的基本原则之一。例如,在水(H2O)中,氧的氧化态为-2,氢的氧化态为+1,因此氧化态之和为0。 单原子离子中元素的氧化态等于离子的电荷,这是另一个重要的原理。例如,在钠离子(Na+)中,钠的氧化态为+1,而在氯离子(Cl-)中,氯的氧化态为-1。 元素氧化态的周期性趋势元素的氧化态决定了其在化学反应中失去或获得电子的能力。它显示了原子从其中性状态添加或移除了多少电子。元素周期表提供了一个有用的框架来理解氧化态的周期性模式,因为它根据元素的原子序数和电子构型将其排列成行和列。以下是一些主要趋势 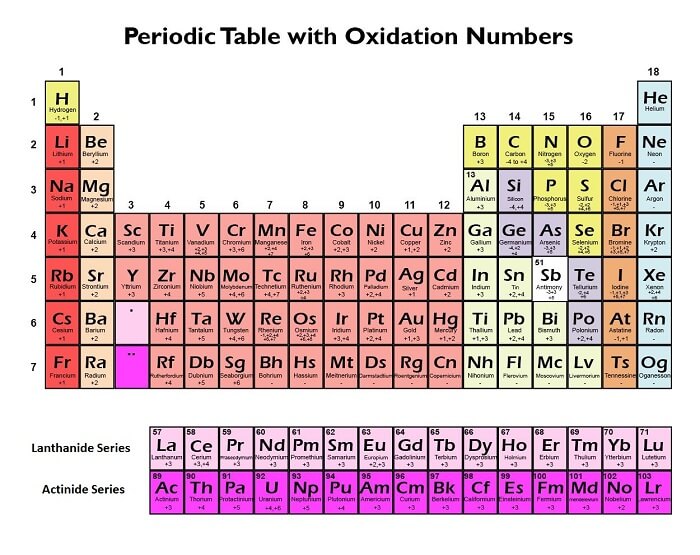 1. 族趋势随着我们在元素周期表中沿着一个族向下移动,氧化态开始上升。这是由于价电子距离原子中心较远,更容易失去或获得。一个很好的例子是第1族碱金属(如锂和钠)的ns1价电子构型,这表明它们的电离能较低,更容易失去其价电子形成+1氧化态。第2族碱土金属(如镁和钙)具有ns2价电子构型,其电离能高于碱金属,但仍倾向于失去两个价电子形成稳定的离子。 2. 周期趋势在元素周期表中,随着我们沿一个周期向右移动,氧化态通常会先上升到某一点,然后下降。这是因为当价电子数保持不变而核电荷增加时,失去电子变得更加困难。例如,周期表右侧的非金属倾向于获得电子并采用负氧化态。第17族卤素(包括氯和氟)具有ns2np5价电子构型,这表明它们对电子具有很强的亲和力,并且倾向于获得一个电子形成-1氧化态。第16族的氧族,包括硫和氧,具有ns2np4价电子排列,表明尽管它们对电子的亲和力低于卤素,但它们仍然可能获得两个电子以达到-2的氧化态。另一方面,随着我们向周期表右侧移动,类金属和金属倾向于失去电子以形成正氧化态。例如,位于周期表中央的过渡金属可以根据它们可以失去的价电子数量来改变其氧化态。由于它们部分填充的f轨道,位于周期表底部的锕系元素和镧系元素通常具有高氧化态。 3. 电负性趋势随着我们从左向右移动,元素的电负性在一个周期内上升。原子的电负性是指原子在化学键中吸引电子的能力。由于它们更容易获得电子,因此具有较高电负性的元素通常具有较高的氧化态。例如,氟是电负性最高的元素,经常形成-1氧化态。 4. 尺寸趋势在一个族中,原子的大小从上到下增加。较大的原子更容易失去电子并形成正氧化态,因为它们通常具有较低的电负性和电离能。例如,碱金属由于其原子尺寸较大,往往会形成+1氧化态并具有较低的电离能。 总的来说,氧化态的周期性趋势可以用许多变量来描述,包括价电子数、电负性、电离能和原子大小。这些模式可用于预测元素及其衍生物的反应性和化学性质 确定氧化态的规范了解元素和化合物的氧化态,是理解其化学反应性和特性至关重要的第一步。以下是确定氧化态的一些建议
这些是确定氧化态的一些一般规则,但根据特定的化合物或情况,可能会有例外和特殊情况。为了分析和预测化学反应和性质,理解氧化态分配的基本原理至关重要。 确定元素化合价的步骤元素与其他原子结合形成化合物的能力通过其化合价来衡量。当元素与其他原子形成化学键时,它代表了可以获得、失去或共享的电子数量。 要找出元素的化合价,您可以遵循以下步骤 1. 确定价电子数 原子外壳中的电子称为价电子。可以使用元素周期表确定价电子数。元素中的价电子数量由其族数表示。例如,第1族元素有一个价电子,而第2族元素有两个价电子。 2. 确定电子构型 原子中电子在不同能级上的排列称为其电子构型。通过查看元素的电子构型,可以部分确定它有多少价电子。例如,氧的电子排列是 1s2 2s2 2p4,这意味着它有 6 个价电子。 3. 确定达到稳定构型所需的电子数 八隅体规则是大多数元素通常在其最外层获得八个电子,从而使其稳定。但也有一些例外,例如氢和氦,它们只需两个电子即可达到稳定的构型。 4. 计算化合价 通过从达到稳定构型所需的电子总数中减去价电子数来计算元素的化合价。如果结果为正,则化合价等于差值。如果结果为负,则化合价是差值的绝对值。 以下是一些例子 钠 (Na):钠的最外层含有一个价电子。它必须失去这个电子才能达到稳定的构型。因此,钠的化合价为 1。 氧 (O):在其最外层,氧有六个价电子。它需要获得两个电子才能达到稳定的构型。因此,氧的化合价为 -2。 铝 (Al):铝 (Al) 的最外层由三个价电子组成。它需要失去三个电子才能达到稳定的构型。因此,铝的化合价为 +3。 为了确定元素的化合价,您必须首先识别其电子结构,计算价电子数,并计算产生稳定电子构型所需的电子数。然后,元素必须获得或失去的电子数等于元素的化合价以达到稳定的构型。 确定元素氧化态的有用规则可用于确定元素氧化态的原理
 前20种元素的化合价以下是前20种元素的化合价
请注意,有些元素,例如氮和磷,根据其所在的特定化合物,具有多种化合价。此外,元素的化合价会根据其反应条件而变化。 下一个主题基础含义 |
我们请求您订阅我们的新闻通讯以获取最新更新。