腺相关病毒2025年7月23日 | 阅读 8 分钟 DNA 作为遗传和疾病的生物分子被发现,为基因疗法铺平了道路,在这些疗法中,突变或受损的基因可以被改变以改善人类状况。 近年来,能够快速、经济地对数十万人进行人类基因组学研究,并测序完整基因组,这导致了核酸序列数据的爆炸式增长,使我们能够识别可能驱动特定疾病状态的基因。如果突变基因能够被“修复”,或者过度活跃/不活跃基因的表达能够被调节,那么疾病就可以在分子水平上得到治疗,在最理想的情况下甚至可以治愈。这一概念似乎尤其适用于单基因遗传病的治疗,这些疾病是由单个基因的突变引起的。近 40 年来,基因疗法一直致力于实现这一目标。 然而,直到最近,这个简单目标仍然难以实现,因为安全地将核酸载体导入细胞的方法落后于识别疾病相关基因的方法。最早考虑的方案之一是利用病毒,病毒是自然存在的生物实体,它们只演化出一种功能:将其 核酸(DNA 或 RNA)转移到宿主细胞并进行复制。 为此可以选择几种病毒载体,每种病毒载体都有其自身的特性,根据所需的功能,这些特性会使其更适合或不适合这项任务。然而,一些病毒载体的不良特性,如其免疫原性或致癌倾向,已导致严重的临床不良事件,并且直到最近,它们在临床上的使用还仅限于疫苗和溶瘤策略等特定应用。更人工化的递送选择,例如纳米颗粒,它们是用于封装核酸、保护其免受降解并通过 细胞膜 的化学制剂,也已显示出一些临床前和临床前景。不出所料,它们也存在一些必须更好地识别和管理的具体不良安全信号。 腺相关病毒 (AAV) 是研究最广泛的基因疗法载体之一。它是在病毒制剂中被发现为污染物的,因此得名。简单来说,AAV 是一种蛋白质外壳,包裹并保护着一个微小的单链 DNA 基因组,其大小约为 4.8 kb。 AAV 属于细小病毒科,需要与其它病毒(主要是腺病毒)共同感染才能有效复制。最初通过血清学分类,AAV 基因的分子克隆已在多种物种中发现了数百种不同的 AAV 菌株。其单链基因组包含三个基因:Rep(复制)、Cap(衣壳)和 aap(组装)。这三个基因通过三个启动子、交替翻译起始位点和差异剪接产生至少九种基因产物。 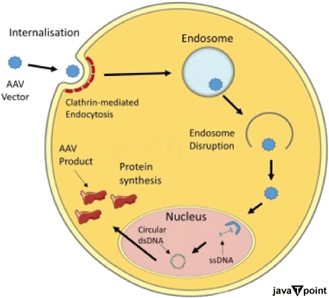 这些编码区被反向末端重复序列 (ITRs) 分隔,这些序列对于基因组复制和包装是必需的。Rep 基因编码四种蛋白质(Rep78、Rep68、Rep52 和 Rep40),它们是病毒基因组复制和包装所必需的,而 Cap 表达产生病毒衣壳蛋白(VP;VP1/VP2/VP3),这些蛋白质形成保护病毒基因组的外部衣壳,并积极参与细胞结合和内吞。 病毒外壳被认为由 60 种蛋白质组成,呈二十面体排列,衣壳蛋白的摩尔比为 1:1:10(VP1:VP2:VP3)。 组装激活蛋白 (AAP) 由 AAP 基因编码,该基因与 cap 基因共享一个替代阅读框。据推测,这种核蛋白充当衣壳组装的支架。虽然 AAP 对 AAV2 中 VP 蛋白的核仁定位和衣壳形成是必需的,但它在近期研究的 11 种其他血清型中的亚核定位不同,并且在 AAV4、AAV5 和 AAV11 中不是必需的。 尽管野生型 AAV 的生物学还有许多未解之谜,但这不是用于制造基因疗法的版本。重组 AAV (rAAV),它不含病毒 DNA,本质上是一种基于蛋白质的纳米颗粒,经过定制,能够穿过细胞膜,最终在细胞核内运输并递送其 DNA 货物。在没有 Rep 蛋白的情况下,rAAV 中表达的 ITR 侧翼转基因可以形成环状共聚体,这些共聚体在转导细胞的细胞核中保持为游离体。由于重组游离 DNA 不会整合到宿主基因组中,因此随着细胞自身的复制,它会随着时间的推移而稀释。 这最终将导致转基因和转基因表达的丢失,丢失的速度取决于转导细胞的更新率。这些特性使rAAV 成为特定基因疗法应用的绝佳选择。以下概述了 AAV、其应用以及更多内容。 AAV 的发现腺相关病毒是在 40 多年前在匹兹堡的 Bob Atchison 实验室和美国国立卫生研究院的 Wallace Rowe 实验室发现的。 两组人都认为,先前被认为是腺病毒制剂中的亚单位杂质的微小颗粒,实际上是细小病毒科的一个属,称为依赖病毒。 AAV 存在复制缺陷,需要腺病毒或疱疹病毒提供辅助功能才能在哺乳动物细胞中有效复制。在其发现后不久,AAV 就从人类中分离出来,但血清学检测,特别是Neil Blacklow 的检测表明,尽管它似乎与辅助病毒(特别是腺病毒)一同在人群中传播,但它与疾病传播无关。  AAV 感染缺乏致病性最有可能解释了为什么它在整个病毒学领域得到的关注很少。然而,在 1969 年,也就是基因分子克隆或 DNA 测序出现近一个世纪之前,AAV 作为一个实验系统就具有一些独特的优势。因为它拥有仅 5 kb 的 DNA 基因组以及可分离的负链,AAV 代表了一个独特的遗传系统,在该系统中可以在人类细胞中研究基因表达。此外,它是一种缺陷病毒,需要腺病毒作为辅助,而腺病毒突变体才刚刚被发现。因此,尽管哺乳动物细胞遗传学处于初级阶段,但似乎可以使用腺病毒突变体来分析 AAV 在宿主背景改变的背景下的情况。这提供了一个整合生物化学和遗传学的机会,这也是我最初被 AAV 吸引的原因。 在 AAV 发现之后,三条同时进行的研究线索,旨在更好地理解其分子生物学、潜伏期和遗传学,最终为设计和制造第一批 AAV 载体提供了信息。然而,随后 AAV 载体日益增多的创造和使用,使我们对 AAV 生物学的了解程度与直接 AAV 研究一样多。 AAV 分子生物学AAV 载体反映了 AAV DNA 的两个重要独特特性。它们包含一根单链 DNA,即转基因盒,以 AAV 基因组反向末端重复序列 (ITR) 为界。在 DNA 测序尚未普及的时代,分析 AAV DNA 以识别其独特结构是一个通过结构分析进行演绎推理的迷人例子。 AAV DNA 的第一个独特特征是由Lionel Crawford 提出的,他仔细地对噬菌体 ΦX174、自主细小病毒小鼠细小病毒 (MVM) 和 AAV 进行了物理化学比较。这三种病毒在颗粒大小、组成和超离心时的浮力密度方面相似,但从 ΦX174 和 MVM 提取的 DNA 是单链的,分子量约为 1.5 × 106,而从 AAV 提取的 DNA 似乎是双链的,分子量约为 3 × 106。 为了解决这个问题,Lionel 提出单个 AAV 颗粒必须包含一个正义或负义互补的单链 DNA,在从颗粒中提取时会重新结合形成双链 DNA。在美国国立卫生研究院,Jim Rose 和 Ken Berns 使用了十年前经典的 Meselson 和 Stahl 密度转移实验的改进版,设计了一个巧妙的实验来检验 Crawford 的假设。他们从在标准培养基或在 BUdR 取代胸腺嘧啶残基的培养基中生长的 AAV 中分离出 DNA,这使得 DNA 在 CsCl 梯度中具有更高的浮力密度。来自单个病毒库的双链 DNA 预期会在轻密度或重密度处成带。然而,如果在 DNA 分离前混合病毒库,产生的双链 DNA 分子会在中间密度处成带。因此,实验表明,具有正义或负义单链 DNA 基因组的颗粒数量相等。 密度取代实验还促成了 AAV DNA 负链和正链的制备性分离。两条链之间 T 残基的不对称性导致变性的 BU 取代的负链在 CsCl 中比正链带的密度更高。这对于确定 AAV mRNA 的模板链(负链)和确定基因组的极性很有用,但更重要的是,它导致了在 AAV DNA 末端观察到反向重复序列。1971 年,在美国国立卫生研究院,我和已故的 George Khoury 一起,通过使用 George 与 Malcolm Martin 建立的分析 SV40 RNA 的系统,用 S1 核酸酶和羟基磷灰石测定 AAV RNA 转录,来分析 AAV RNA 转录。  然而,他有了一个更令人兴奋的发现,即分离出的 AAV DNA 负链或正链在羟基磷灰石上结合和洗脱时,就像它们是双链一样,但只有一小段链负责这种行为。他推测 AAV DNA 末端包含一个反向重复序列,因为这将使任何复制形式的两个末端具有相同的序列,并可能解释为什么复制可以从任一末端开始,最终将分离的链包装到单个颗粒中。这很快通过电子显微镜的直接观察得到了证实,显示 AAV DNA 单链可以形成氢键连接的单链圆,因此必须包含一个反向末端重复序列。 与此同时,约翰霍普金斯大学的 Ken Berns 和 Tom Kelly 使用有限的外切核酸酶降解双链 AAV DNA,然后进行电子成像,以观察双链环状分子的产生。这表明直接末端重复可以促进双链环状分子的产生。反向和直接末端重复序列的存在表明存在一个同时具有这两种特征的末端回文序列。预期末端回文序列会形成发夹结构,并且在一系列在我实验室(当时在美国国立糖尿病、消化和肾脏疾病研究所,NIH)和 Berns 实验室进行的测试中,已证明了额外的结构复杂性。使用新发现的限制性内切核酸酶,他在 AAV DNA 的两端发现了两种类型的双链末端。与 David Denhardt 对 AAV 双链 DNA 进行 5' 32P 端标记的实验显示,一种是线性双链,另一种具有非线性的十字形或兔耳状结构。 结论腺相关病毒 (AAV) 已成为基因疗法中一种多功能且有前途的载体,其特点包括最低的免疫原性、长期的基因表达以及靶向多种组织的潜力。AAV 的非致病性以及处理各种基因载荷的能力,使其成为一种可靠的治疗工具。AAV 工程技术的不断进步,例如开发新型衣壳变体和改进的递送系统,已增强了其治疗各种疾病的潜力,包括罕见的遗传异常、癌症和神经系统疾病。 尽管取得了这些进展,但仍然存在挑战,包括扩大生产规模、减少免疫反应以及确保 AAV 药物的公平获取。未来的研究应致力于克服这些局限性,同时解决长期的安全性和有效性问题。通过持续的创新和全面的临床审查,AAV 有可能彻底改变现代医学的面貌,为患有迄今为止无法治疗的疾病的患者带来希望。 下一个主题什么病毒引起疣 |
我们请求您订阅我们的新闻通讯以获取最新更新。