鼠疫耶尔森氏菌2025年7月21日 | 阅读 12 分钟 引起鼠疫的细菌,鼠疫耶尔森菌,是肠杆菌目耶尔森菌科的成员。鼠疫耶尔森菌是革兰氏阴性球杆菌,呈球形至圆柱形,外层脂多糖膜包裹着一层薄薄的肽聚糖细胞壁。它也是一种兼性厌氧菌,因此可以在有或没有游离氧气的情况下生长。 法国细菌学家耶尔森于1894年在香港鼠疫爆发期间发现了鼠疫耶尔森菌。日本医生兼细菌学家北里柴三郎被派往香港调查疫情,同年他自己也发现了这种细菌。1898年,法国医生保罗-路易斯·西蒙德发现鼠疫耶尔森菌通过感染跳蚤叮咬从啮齿动物传播给人类,这大大推进了对鼠疫的科学认识。1896年,出生于俄罗斯的细菌学家瓦尔德马·莫迪凯·哈夫金开始开发抗血清来治疗感染,研究人员努力更好地描述鼠疫耶尔森菌。从1897年开始,哈夫金的疫苗接种给数百万印度人,并一直持续到20世纪20年代中期。  14世纪的黑死病和5-7世纪的查士丁尼瘟疫都是由鼠疫耶尔森菌爆发引起的,导致欧洲三分之一的人口死亡。这是有记载历史上最具破坏性的两次鼠疫流行。19世纪末20世纪初始于亚洲的大规模流行病最终蔓延到世界其他地区,造成数百万人死亡。尽管哈夫金的疫苗可用,但在19世纪90年代末至1917年间,印度约有550万至600万人死于鼠疫。此后,由于公共卫生举措和抗生素的发展,鼠疫爆发的发生率和强度显著降低,从20世纪30年代的磺胺类药物开始。然而,鼠疫耶尔森菌仍然存在于世界某些地区,特别是在家养或野生啮齿动物高度集中的地区,这些啮齿动物携带着可能将细菌传播给人类的跳蚤。 如今,许多药物,如环丙沙星、多西环素、庆大霉素或链霉素,可用于治疗鼠疫耶尔森菌感染。通过血清学检查,可以通过发现细菌和抗鼠疫抗体来诊断感染。基于DNA的技术的出现使得在考古遗址(特别是在欧洲)采集的组织样本中识别鼠疫耶尔森菌遗传物质成为可能,鼠疫在6世纪到17世纪是主要的死亡原因。 一般特征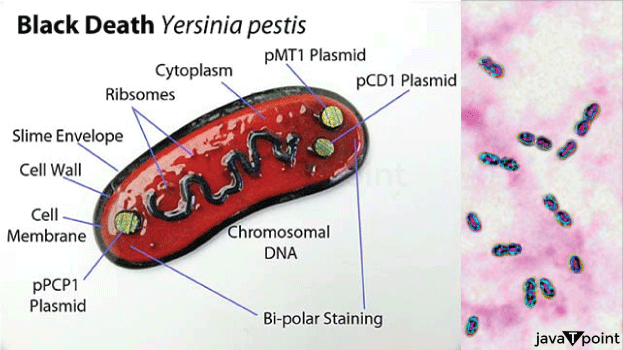 鼠疫耶尔森菌是一种兼性厌氧菌,不具运动性,并产生抗吞噬的粘液层。它具有两极染色,使其看起来像安全别针。与许多其他耶尔森菌属物种一样,它对尿素酶、乳糖发酵和吲哚呈阴性。虽然它能耐受各种温度和pH值,但该物种在28-30°C和7.2-7.6左右生长最慢。如果暴露在紫外线辐射下,干燥或达到40°C以上的温度,它会异常迅速死亡。耶尔森菌属有十一个物种,其中三个对人类具有致病性。由假结核耶尔森菌和肠道耶尔森菌引起的疾病是另外两种;通常,人们通过食用受污染的食物或水感染这些疾病。 识别和分离的历史日本细菌学家北里柴三郎和瑞士细菌学家亚历山大·耶尔森于1894年在香港分别发现了导致香港鼠疫的细菌。尽管两位研究人员都发表了他们的结果,但北里前后矛盾的言论最终导致耶尔森被认为是该生物的主要发现者。耶尔森以他的工作单位巴斯德研究所的名字将其命名为鼠疫巴斯德菌。1967年,为纪念他,它被转移到一个新的属并命名为鼠疫耶尔森菌。根据耶尔森的说法,许多当地人认为鼠疫是一种老鼠的疾病,当发现大量死老鼠时,中国和印度的村民声称鼠疫爆发随之而来。已知老鼠不仅在鼠疫流行期间,而且通常在人类爆发之前也受到鼠疫的影响。 法国科学家保罗-路易斯·西蒙德曾到中国对抗第三次鼠疫大流行,他在1898年确定了这种疾病的老鼠-跳蚤媒介。他曾观察到,人们在不靠近彼此的情况下也可能染病。当他们发现死老鼠时,云南的人们会夺路而逃。同样,台湾福尔摩沙岛上的人们认为,接触死老鼠会增加感染鼠疫的风险。他推断,因为人们只通过接触在过去24小时内死亡的死老鼠而感染鼠疫,所以跳蚤可能在疾病传播中起到媒介作用。在一项现在被认为是经典的实验中,西蒙德展示了携带鼠疫的跳蚤如何从一只最近死亡的老鼠跳到一只健康的老鼠身上,导致健康的老鼠死于疾病。[从1900年到1904年,疫情蔓延到旧金山的唐人街。从1907年到1909年,它蔓延到奥克兰和东湾。此后,由于官员决定长期隐瞒唐人街居民的死亡,该疾病得以传播到附近地区广泛分布的本地啮齿动物物种,担心疫情对商业的影响,因此它一直存在于北美西部啮齿动物种群中。 目前已发现三种鼠疫菌株:引起当前大流行的鼠疫假单胞菌;在6世纪引发鼠疫大流行的鼠疫古菌;以及在第二次大流行浪潮中导致黑死病和其他流行病的鼠疫中菌。 鼠疫耶尔森菌的基因组和质粒引起鼠疫的鼠疫耶尔森菌的基因组应反映其致病潜力和进化史。鼠疫耶尔森菌的基因组约为4.6百万碱基对,有一个环状染色体和几个质粒,这些质粒对鼠疫耶尔森菌的毒力和适应性做出了重大贡献。它编码了许多与基本细胞过程、代谢甚至致病性相关的基因。然而,鼠疫耶尔森菌的基因组有一些独特的特征。鼠疫耶尔森菌还携带许多假基因,这与它从与假结核耶尔森菌密切相关的肠道祖先进化而来是一致的。这些假基因反映了其在哺乳动物宿主或跳蚤媒介中致病生活方式不再需要的许多功能的放弃,以及鼠疫耶尔森菌适应其高度专业化的寄生生命周期而导致的整体基因组退化。然而,这种生物在其染色体上保留了一些重要的毒力因子,包括III型分泌系统(T3SS),它直接将毒素注入宿主细胞以阻止它们产生免疫反应。car基因座是编码T3SS的致病岛。 除了染色体,鼠疫耶尔森菌还包含三个主要质粒:pMT1 (pFra)、pCD1 (pYV) 和 pPCP1 (pPla),它们对其致病性至关重要。约100 kb的pMT1质粒携带ymt基因,该基因编码鼠疫毒素,这种毒素与小鼠的生存有关,使鼠疫耶尔森菌能够在跳蚤肠道内生存,从而通过跳蚤叮咬在哺乳动物之间传播。它还携带F1荚膜抗原,这是一种在细菌周围形成荚膜的蛋白质,通过这种方式,通过防止吞噬作用来帮助逃避宿主免疫系统。约70 kb的pCD1质粒编码ysc和lcr基因座,编码上述T3SS结构及其差异表达和调控。总的来说,这些使细菌能够将效应蛋白递送到宿主细胞中,从而克服主要的免疫防御。虽然耶尔森菌的所有致病物种都共享此质粒,但此质粒的存在——特别是通过其在鼠疫耶尔森菌引起疾病(包括抑制宿主炎症反应)中的作用——至关重要。第三个质粒pPCP1最小,约9.6 kb,但它对毒力至关重要。它携带pla基因,该基因将编码纤溶酶原激活剂蛋白酶,该酶在细菌通过哺乳动物组织传播中很重要。纤溶酶降解纤维蛋白凝块和细胞外基质成分,使感染从入口点扩散到血液和淋巴系统,导致败血症和淋巴结炎,这是淋巴结鼠疫的特征。 除了提供携带在跳蚤和哺乳动物宿主中生存所需的毒力因子的质粒外,这些质粒还使鼠疫耶尔森菌能够迅速适应环境变化,从而完成其传播周期。从肠道细菌到引起致命感染并可通过鼠疫耶尔森菌广泛传播的高度毒性病原体的进化转变,以相对减少、衰退的染色体和高度特化的质粒的整合为特征。因此,其基因组结构反映了它作为适应跳蚤和哺乳动物的病原体的生命,其中不必要基因的丢失通过质粒的获取和维持得到补偿,这些质粒确保了其在这些宿主中的毒力和持续性。鼠疫耶尔森菌的基因组和质粒谱仍然是研究其进化和毒力机制以及可能对抗下一次鼠疫爆发的重要工具。 致病性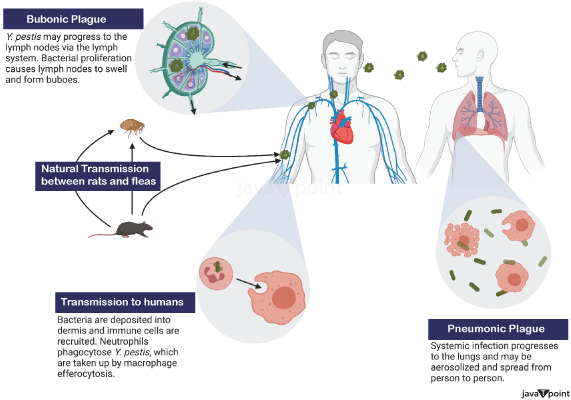 鼠疫耶尔森菌的大部分传播发生在城市和森林循环中的老鼠和跳蚤之间。在城市循环中,褐鼠(挪威鼠)是主要的啮齿动物,但在森林循环中,则是野生啮齿动物。此外,鼠疫耶尔森菌可以在市区内外传播。人类通常通过跳蚤叮咬感染这种疾病。如果疾病发展到肺鼠疫形式,人类可以通过空气中的呼吸道飞沫将细菌传播给其他人;以这种方式感染鼠疫的人很可能自己也患上肺鼠疫。 哺乳动物作为宿主鼠疫杆菌的主要环境宿主是多种啮齿动物。土拨鼠被认为是草原地区主要的自然宿主。据信,美国西部的许多啮齿动物物种都携带鼠疫杆菌。然而,没有啮齿动物表现出预期的疾病动态。已知许多啮齿动物物种表现出不同的抵抗力,这可能导致无症状携带状态。有证据表明,来自其他动物的跳蚤导致了人类鼠疫流行。 与对黑尾土拨鼠(Cynomys ludovicianus)等敏感啮齿动物一样,鼠疫可能导致群落崩溃并对草原食物网产生重大影响,关于鼠疫在哺乳动物物种中的动态知之甚少。然而,土拨鼠的传播动态与被阻断的跳蚤不同;相反,尸体、未被阻断的跳蚤或其他载体可能很重要。 一名患者在感染了受感染的猫后死于肺炎,他就是 CO92 菌株的来源。该感染的宿主在世界其他地区尚不清楚,这使得预防和早期预警工作更加困难。2003 年阿尔及利亚爆发疫情期间就发生过这样的情况。 跳蚤作为媒介对跳蚤如何传播鼠疫耶尔森菌有清晰的描述。媒介首先在吸食受感染动物的血液时感染鼠疫耶尔森菌。血红素储存系统和耶尔森鼠毒素(Ymt)是两种随后支持细菌在跳蚤消化道中存活的蛋白质。Ymt 对啮齿动物剧毒,被认为是为确保新宿主再次感染而准备的,它对于跳蚤定植和鼠疫耶尔森菌在跳蚤中的存活至关重要。 为了使鼠疫耶尔森菌回到哺乳动物宿主,血红素储存机制至关重要。当血红素储存系统基因座编码的蛋白质存在于昆虫载体中时,前胃(连接中肠和食道的瓣膜)会形成生物膜。这种生物膜似乎是跳蚤稳定感染所必需的。随着凝血和细菌的聚集,生物膜中的聚集会阻止进食(被称为“巴科特氏阻塞”,以首次描述这种现象的昆虫学家 A.W. Bacot 的名字命名)。跳蚤徒劳的进食努力是鼠疫耶尔森菌传播的时候。血液被泵入食道,在那里它会分解滞留在前胃中的微生物。然后血液被反流回宿主的循环系统。 在人类和其他易感宿主中鼠疫杆菌在哺乳动物宿主中的感染导致发病有多种原因,包括细菌抑制和逃避吞噬作用和抗体形成等典型免疫系统反应的能力。细菌能够通过跳蚤叮咬穿透表皮屏障。作为肺鼠疫的重要毒力因子,鼠疫杆菌会产生一种纤溶酶激活剂,可以分解血凝块以促进全身性侵袭。细菌的许多毒力因子都是抗吞噬的。F1(片段1)和V或LcrV是两个重要的抗吞噬抗原,对致病性至关重要。当人体体温正常时,细菌会产生这些抗原。此外,尽管留在单核细胞等白细胞中,鼠疫杆菌在其中繁殖并产生F1和V抗原,但在中性粒细胞中不产生。针对F1和V抗原的特异性调理抗体的产生导致自然或诱导免疫;针对F1和V的抗体导致中性粒细胞吞噬。 此外,鼠疫耶尔森菌可以通过 III 型分泌系统 (T3SS) 将蛋白质注入巨噬细胞和其他免疫细胞。这些 T3SS 注射的蛋白质,称为耶尔森菌外膜蛋白 (Yops),包括 Yop B/D。这些蛋白质与细胞溶解相关,并在宿主细胞膜上形成孔洞。T3SS 通过 YopB 和 YopD 部分形成的孔洞,将 YopO、YopH、YopM、YopT、YopJ 和 YopE 注入宿主细胞的细胞质中。如下所示,注射的 Yops 抑制细胞信号通路和吞噬作用,这些是先天免疫系统的关键组成部分。此外,一些鼠疫耶尔森菌菌株可以破坏免疫信号(例如,通过阻断特定细胞因子的产生)。 鼠疫杆菌在淋巴结内生长,在那里巨噬细胞等免疫系统细胞无法摧毁它。鼠疫杆菌可能在淋巴结中发育并引起淋巴结病,因为它能够阻止吞噬作用。酪氨酸磷酸酶YopH是一种帮助鼠疫杆菌逃避免疫系统细胞的蛋白质。p130Cas、Fyb(FYN结合蛋白)、SKAP-HOM和Pyk(一种类似于FAK的酪氨酸激酶)都被证明在巨噬细胞中被YopH去磷酸化。此外,YopH结合Vav鸟嘌呤核苷酸交换因子、Gab1和Gab2衔接蛋白以及磷脂酰肌醇3激酶的p85亚基。 对于RAC1等Rho家族GTP酶,YopE充当GTP酶激活蛋白。通过消除异戊二烯基团(蛋白质定位于细胞膜所必需的),半胱氨酸蛋白酶YopT抑制RhoA。有研究表明YopE和YopT共同作用以限制YopB/D引起的细胞溶解。这可能会限制YopB/D形成Yop插入宿主细胞的孔的能力,并阻止YopB/D破裂宿主细胞并释放细胞内容物,从而吸引并激活免疫系统反应。 乙酰转移酶YopJ附着在MAPK激酶的保守α螺旋上。当MAP激酶级联被激活时,YopJ在通常被磷酸化的丝氨酸和苏氨酸位点对MAPK激酶进行乙酰化。YopJ与靶细胞植酸(IP6)相互作用,在真核细胞中激活。巨噬细胞因此中断宿主细胞蛋白激酶活性,这被认为是感染建立和免疫反应逃避的关键,从而导致细胞凋亡。耶尔森菌蛋白激酶A(YpkA)是蛋白激酶YopO的另一个名称。YopO是人类巨噬细胞凋亡的有效诱导剂。 也有建议认为,噬菌体Ypφ可能是导致这种生物致病性增强的原因。 鼠疫通常会损害宿主细胞与免疫系统相互作用的能力,从而阻止身体将吞噬细胞输送到感染部位。然而,一个人所患的具体疾病取决于他们所患鼠疫的类型。 鼠疫杆菌以多种方式致死。有记载称它除了人类和啮齿动物外,还杀死了猪、家禽和骆驼。尽管猫在感染后更容易生病,但家犬和家猫都易感染鼠疫。无论哪种情况,症状都可能对动物致命,并且与人类经历的症状相似。吸入病狗或病猫咳嗽到空气中的感染性飞沫,或接触感染的动物——无论是死的还是活的——都可能使人类暴露。 结论鼠疫耶尔森菌这种导致鼠疫的细菌,在人类历史上留下了痕迹。这种致命病原体主要通过跳蚤和啮齿动物传播,并导致三种形式:淋巴腺鼠疫、败血症鼠疫和肺鼠疫。症状差异和传播方式使其具有毁灭性影响。现代医学的进步,特别是抗生素和疫苗,已大大降低了鼠疫耶尔森菌感染的影响,尽管它仍然在世界某些地区找到了一席之地,在那里它以某种方式获得了繁衍的环境。 公共卫生计划、监测和适当的治疗干预措施有助于控制疫情,但只有通过警惕才能防止下一次大流行。这种细菌的生存和传染性确实强调了持续研究和规划的必要性,以便像鼠疫这样的另一种人畜共患疾病在当今全球社会中不再入侵世界。 下一个主题蓝细菌 |
我们请求您订阅我们的新闻通讯以获取最新更新。