变形链球菌2025年7月22日 | 阅读13分钟 齿链球菌(Streptococcus mutans)是一种常见于人体口腔的革兰氏阳性兼性厌氧球菌(圆形细菌),在龋齿的形成中起着重要作用。该微生物最初由James Kilian Clarke于1924年描述。 这种细菌可以与密切相关的齿科链球菌(Streptococcus sobrinus)共存于口腔中。两者都会引起口腔疾病,因此在实验室检测中,临床上通常不需要花费成本来区分它们。因此,在临床上,它们经常被统称为齿链球菌。 生态S. mutans 和至少25种其他的口腔链球菌天然存在于人体口腔微生物群中。这些细菌的分类仍在进行中。每种细菌都有独特的定植于不同口腔部位的特征,并且口腔的不同区域具有独特的生态位。S. mutans 在口腔链球菌中占40%,尤其常见于窝沟。颊面上的S. mutans 细菌较少(2-9%)。 细菌和真菌的共聚集可能促进S. mutans 增加致龋活性。在与白色念珠菌(Candida albicans)和S. mutans 的共生关系中,葡聚糖的合成和生物膜的形成得到增强。因此,这会增加S. mutans 的致龋影响。 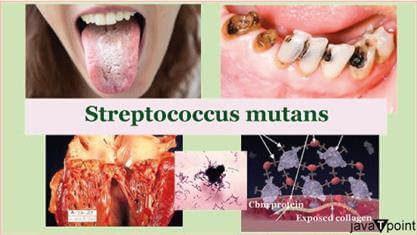 口腔链球菌中既有益生菌也有致病菌。但在某些情况下,共生链球菌可能转变为机会致病菌,从而损害宿主并引起疾病。口腔疾病可能由微生物群失衡引起。口腔中存在机会致病性酵母菌白色念珠菌。就早期儿童龋齿而言,其在生物膜中的存在会促进更高水平的S. mutans。它会促进S. mutans 微菌落的生长。这通过利用生物膜中获得的低水平的跨界代谢产物(包括法呢醇)来实现。有人提出,当两种微生物存在时,会产生更高密度的生物膜基质。法呢醇浓度高时,S. mutans 和白色念珠菌的增殖都会受到抑制。这会减轻生物膜的病理生理学,从而降低其促进牙齿龋坏的能力。这增加了使用抗真菌药物来预防牙齿龋坏的可能性。 在疾病中的作用牙齿腐烂淋球菌属(Neisseria)和链球菌属,特别是S. mutans,是牙齿表面的主要早期定植菌。它们必须足够牢固地附着在牙齿的硬组织上,才能抵抗口腔清洁(如唾液和舌头的运动)的力。这些先锋物种的生长和代谢会改变局部环境因素(如pH、共聚集、底物可用性和Eh),从而使更挑剔的生物体能够后期定植并产生牙菌斑。S. mutans 将蔗糖转化为乳酸,是与S. sobrinus 一起导致牙齿龋坏的关键因素。这个过程在口腔中产生的酸性环境使高度矿化的牙釉质容易发生龋坏。 S. mutans 是少数具有增强牙齿表面附着力受体的特化生物之一。为了帮助它们相互结合并形成牙菌斑,S. mutans 使用葡聚糖转化酶将蔗糖转化为基于葡聚糖的细胞外粘性多糖。S. mutans 利用蔗糖作为底物,**通过以下过程利用己糖基转移酶葡聚糖合成酶生成葡聚糖:** n 蔗糖 → (葡萄糖)n + n 果糖 细菌只能使用蔗糖生产这种粘性多糖。 S. mutans 还可以分解其他糖类,如葡萄糖、果糖和乳糖,但最终产物是乳酸。牙菌斑和酸的结合是牙齿龋坏的原因。由于其在牙齿龋坏中的重要性,已进行了许多尝试来开发针对S. mutans 的疫苗。此类疫苗尚未在人类中被证明有效。最近有研究表明,参与S. mutans 牙齿定植的蛋白质会产生抗体,从而阻止致龋过程。 在耶鲁大学和智利大学新合成的分子Keep 32被认为能够杀死S. mutans。在UCLA合成的肽C16G2是另一个潜在的选择。据信,齿链球菌通过水平基因转移将允许其形成生物膜的基因转移给了其他乳酸菌,如乳杆菌。S. mutans是导致牙菌斑(牙齿龋坏或蛀牙)的主要原因菌和致病菌,尤其是在发生和发展阶段,它生活在口腔中。 牙菌斑中存在600多种不同的微生物,牙菌斑通常是牙齿龋坏的早期迹象。这些微生物共同构成了口腔动态环境,口腔环境经常经历pH、营养可用性和氧张力的急剧变化。牙菌斑是牙齿表面的生物膜,而牙菌斑由附着在牙齿上的细菌细胞组成。S. mutans 和牙菌斑经常接触到来自烟雾、食品添加剂和口腔护理产品的“有毒化合物”。 当S. mutans 在生物膜中生长时,细胞会维持新陈代谢的平衡,包括产生和解毒。生物膜是微生物的集合,其细胞相互粘附或粘附到表面。事实上,生物膜群落中的细菌可以产生各种有害物质,阻碍竞争性微生物的生长。 为了有效地定植并在口腔中保持优势地位,S. mutans 随着时间的推移进化出了策略。环境变化对牙菌生物膜提出了持续的挑战。细菌种群对这些变化做出反应,每个成员都承担着独特的角色,以确保在口腔中的生存。 为了在恶劣环境中保护自己,S. mutans 已经从限制其进食能力的状况中进化而来。口腔细菌中20%是链球菌,它们实际上控制着生物膜的形成。一旦S. mutans 在口腔生物膜中建立起优势地位,即使先锋定植菌可以抵抗它们,牙齿龋坏也会形成并蓬勃发展。 致龋潜力其致龋能力与其代谢不同糖类、形成坚固生物膜、产生大量乳酸以及在自身产生的酸性环境中生长有关。一项关于牙菌斑pH的研究表明,牙齿硬组织(牙本质和牙釉质)脱矿的关键pH为5.5。在进食零食或午餐后,正如Stephan曲线所见,牙菌斑pH可能很快降至5.5以下。 饮食中糖和可发酵碳水化合物的摄入量增加与牙齿龋坏有关,牙齿龋坏是一种由牙菌生物膜引起的口腔疾病。当牙菌生物膜残留在牙齿表面,并且糖频繁暴露于其中时,产酸菌(牙菌生物膜的成员)会将碳水化合物转化为有机酸。如果放任不管,牙齿龋坏是影响全球人口的最常见疾病。由于其在低pH环境中的生存能力,产酸菌和耐酸菌在这种酸性环境持续存在时会大量繁殖。 生物膜基质的低pH会侵蚀牙齿表面并引发牙齿龋坏的“起始”。齿链球菌是口腔环境中常见的细菌,被认为是帮助这种起始的重要微生物。S. mutans 在持续低pH的培养物中占主导地位,因为它在酸性环境中生长良好。如果S. mutans 附着在牙齿表面的能力或其在牙菌生物膜中的生理能力(产酸性和耐酸性)能够被减弱或消除,那么牙菌生物膜的酸化潜力和随后的龋坏形成就可以被最小化。 如果能阻止不同病变早期阶段的发展,使其不再超过白斑阶段,那就太理想了。一旦超过这一点,就没有生物学方法可以修复牙釉质表面,因为它已被不可逆地破坏。早期牙齿焦虑可能由此产生,而龋坏病变的疼痛对幼儿来说可能非常令人痛苦。牙齿焦虑会影响患者和牙科专业人员。治疗计划和随后的成功可能会受到影响。与焦虑的儿童合作可能会给牙科专业人员带来压力和挫败感。因此,与孩子的父母的关系可能会受到影响。研究表明,存在一种循环,患者因牙齿焦虑而忽视口腔组织的护理。 在疼痛变得难以忍受之前,他们可能会试图避免看牙医,有时甚至会忽视口腔卫生。 疾病易感性的个体差异导致了免疫途径的提出,这些途径要么提供保护,要么增加对疾病的易感性。尽管确切机制尚不清楚,但S. mutans 似乎在体外激活抗原呈递细胞,但在体内不引起它们反应。对粘膜表面的S. mutans 表现出免疫耐受的个体可能更容易受到S. mutans 定植的侵扰,从而更容易患上牙齿龋坏。 在儿童中虽然S. mutans 通常在牙齿萌出时被口腔获得,但在尚未完全出牙的儿童口腔中也发现了它。从看护者(通常是母亲)垂直传播给孩子是最常见但不是唯一的方式。这也很常见于父母清洁孩子的奶嘴或在将奶嘴放入孩子嘴里之前先用自己的嘴尝试味道。 心血管疾病S. mutans 分别以68.6%和74.1%的发生率成为动脉粥样硬化斑块和摘除的心脏瓣膜组织中最常见的细菌种类。它也与某些心血管疾病的病理生理学有关。与S. mutans 密切相关的、同样普遍存在于口腔中的血链球菌(Streptococcus sanguinis)已被证明会引起感染性心内膜炎。 齿链球菌(Streptococcus mutans)与感染性心内膜炎(IE)和菌血症有关。IE分为急性和亚急性两种,在亚急性病例中会分离出细菌。发烧、寒战、出汗、食欲不振、体重减轻和不适是典型症状。已确定S. mutans 的四种血清型:c、e、f和k。血清型根据血清型特异性鼠李糖-葡萄糖聚合物的化学组成进行分类。例如,首先在血液分离物中发现的K血清型,其连接到鼠李糖骨架上的葡萄糖侧链数量显著减少。S. mutans 的表面蛋白抗原包括葡聚糖转化酶、蛋白抗原和葡聚糖结合蛋白。没有这些表面蛋白抗原,细菌就是一个蛋白抗原缺陷突变体,最不容易被吞噬,因此对细胞的损害也最小。在感染了从感染性心内膜炎患者受损心脏瓣膜获得的葡聚糖转化酶缺陷型链球菌突变体(S. mutans 菌株)的啮齿动物试验中,也观察到菌血症的持续时间延长。研究结果表明,特定细胞表面组分的出现与S. mutans 引起的感染性心内膜炎的毒力有关。 此外,与其他的牙周细菌相比,在心血管标本中检测到的S. mutans DNA比例更高。这表明它可能不仅涉及菌血症和感染性心内膜炎,而是涉及多种心血管疾病。 预防与治疗通过良好的口腔卫生习惯,包括每天刷牙、使用牙线和使用合适的漱口水,可以显著减少口腔细菌(包括S. mutans)的数量并抑制其生长。由于S. mutans 经常存在于牙菌斑中,机械清除牙菌斑是清除它们的一种有效方法。改良的Bass刷牙法是减少牙菌斑堆积和降低牙齿龋坏发生率最有效的刷牙方法。每天刷牙两次可以降低牙齿龋坏的风险。尽管如此,除了机械清洁外,还使用了几种治疗方法来治疗口腔细菌感染。这些包括洗必泰(chlorhexidine),它似乎通过干扰细菌附着来起作用,以及氟化物(fluoride),它直接抑制烯醇化酶。 此外,氟离子可能会损害细菌细胞的新陈代谢。氟化物直接抑制H+ ATP酶和糖酵解酶。氟离子还会降低细胞质的pH。因此,在细菌糖酵解过程中产生的酸会减少。因此,含氟漱口水、牙膏、凝胶和清漆可以帮助降低牙齿龋坏的发生率。然而,关于含氟清漆如何影响儿童口腔中S. mutans 数量的研究结果表明,牙菌斑或唾液中S. mutans 数量的减少并不能解释龋齿发生率的降低。无论是否进行过牙科护理,氟清漆治疗对S. mutans 在牙菌斑和唾液中的水平没有显著影响。 葡聚糖转化酶(Glucosyltransferase)由S. mutans 在其细胞壁上分泌,使细菌能够将蔗糖转化为多糖。这些粘性多糖导致细菌聚集并附着在牙釉质上,或形成生物膜。通过干扰S. mutans 附着在牙釉质上的能力,抗细胞相关葡聚糖转化酶(Anti Cell-Associated Glucosyltransferase (Anti-CA-gtf))免疫球蛋白Y阻止其增殖。研究表明,Anti-CA-gtf IgY能够选择性且有效地抑制口腔中的S. mutans。其他流行的预防策略侧重于减少糖的摄入。一种方法是使用糖替代品,如赤藓糖醇或木糖醇,它们无法转化为通常促进S. mutans 生长的糖。五碳糖木糖醇通过在糖酵解过程中产生有害的中间产物来干扰S. mutans 的能量产生能力。其他天然疗法,如脱甘草甜素的甘草根提取物、茶树油、马齿苋素(存在于肉豆蔻中)、姜黄素(姜黄的主要成分)和丁香酚(存在于月桂叶、肉桂叶和丁香中),已被提出或部分研究。许多茶也被研究用于抵抗S. mutans 和提供其他牙科益处的潜力。 最近发现了可以特异性抑制或分散S. mutans 生物膜的小分子抑制剂。此外,通过基于结构的药物设计,发现了靶向S. mutans 葡聚糖转化酶的选择性抑制剂。临床前动物模型证明了这些先导化合物的有效性。然而,无论是科学试验还是主要的口腔健康组织,都没有推荐任何这些针对S. mutans 的疗法。 当生物活性玻璃珠被添加到牙科复合材料中时,S. mutans 更不容易进入复合材料与牙齿之间的小缝隙。由于其抗菌特性,它们减少了微生物的侵入。这降低了继发龋的发生率,而继发龋是牙科修复失败的常见原因。这意味着复合材料修复可能更有效、更持久。 已经对靶向S. mutans 的噬菌体(一种感染细菌的病毒)进行了研究。在实验室环境中,噬菌体在减少S. mutans 方面显示出潜力,这可能提供一种有针对性的策略来预防牙齿龋坏,而不会危及口腔微生物群。SMHBZ8是已识别出的感染S. mutans 的噬菌体之一。 在压力条件下生存口腔环境多变而复杂,常常在极端之间波动。因此,S. mutans 必须能够耐受多种抗菌剂和快速的恶劣环境变化,才能在口腔中生存。细菌适应的一种称为“转化”的现象,是指DNA通过周围介质从一个细菌转移到另一个细菌。转化是一种原始的有性生殖方式。细菌需要达到一种称为“感受态”的特殊生理状态,才能结合、吸收并将其外部DNA重组到其染色体中。S. mutans 中的遗传感受态受一种肽信息素群体感应信号机制调控。 当S. mutans 细胞处于密集的生物膜中时,这种技术效果很好。与在拥挤环境中生长的单细胞(浮游细胞)相比,在生物膜中生长的S. mutans 细胞的转化速度要快10-600倍。感受态诱导似乎是对由压力、拥挤环境引起的DNA损伤的一种适应。 理解群体感应为潜在的药物和治疗开发打开了大门。可以修改群体感应肽来诱导靶细胞自杀。此外,可以通过猝灭群体感应来避免抗生素耐药性。 演变通过改善其对口腔环境的适应能力,S. mutans 已经发展出三个关键特征,增强了其毒力:产生更多有机酸的能力,在牙齿硬表面形成生物膜的能力,以及在低pH环境中生存和生长的能力。 随着S. mutans 的进化,它获得了代谢更多碳水化合物的能力,这导致了更多有机酸的产生作为副产品。由于口腔酸度升高会加速牙齿脱矿,从而导致龋齿,这对于牙齿龋齿的发展至关重要。 这种特征被认为是通过与另一种口腔细菌物种的侧向基因转移而进化的。S. mutans 表现出与碳水化合物代谢相关的多种基因的上调,包括SMU.438和SMU.1561。这些基因可能分别来自S. gallolyticus 和Lactococcus lactis。S. mutans 获得葡聚糖转化酶(GTF)基因是侧向基因转移的另一个例子。最有可能的是,口腔中的其他厌氧菌,如乳杆菌或明串珠菌,是S. mutans 中GTF基因的来源。此外,S. mutans 中的GTF基因与乳杆菌和明串珠菌中的GTF基因之间存在同源性。据认为,共享的祖先基因促进了碳水化合物的水解和连接。 S. mutans 不仅能耐受,还能在酸性环境中茁壮成长的能力是其第三个进化特征。由于这一特征,S. mutans 对其他口腔微生物成员具有选择优势。因为成熟的牙菌斑的酸性pH可达4.0,S. mutans 可能能够与其他物种竞争并在口腔的其他区域定植。最有可能负责这一特征的进化过程是自然选择。 有必要提及人类在S. mutans 进化中所扮演的角色,以及两者之间的协同进化。细菌的生理进化就像人类的 theanthropological 进化一样。大多数人同意,农业的引入给早期人类种群创造了理想的环境,使S. mutans 发展成为今天这种致命的细菌。由于农业,历史人类种群开始食用发酵食品和更多高碳水化合物的食物。 这些新型食物产生了新的环境条件,并将新的微生物带入了口腔。例如,酸奶和葡萄酒等食物通常含有乳杆菌或明串珠菌。此外,更多的碳水化合物摄入降低了口腔的pH值,并增加了S. mutans 可代谢的糖量。能够以较低pH值生存和繁殖的细菌在这种新的酸性环境中将被选择。 工业革命带来了口腔环境的又一次重大转变。由于更有效的食品生产和精炼,人类的糖摄入量和可获得性有所增加。这加剧了本已上升的牙齿龋坏率,从而为S. mutans 提供了更多的能量来源。纯蔗糖,即精制糖,是唯一可以转化为粘性葡聚糖的糖,这使得细菌能够形成厚实、牢固附着的牙菌斑。 下一主题 |
我们请求您订阅我们的新闻通讯以获取最新更新。