摩尔浓度定义17 Mar 2025 | 4 分钟阅读 在化学中,摩尔浓度是浓度单位,用于表示溶液中溶质的含量。它被描述为每升溶液中溶质分子的数量。摩尔浓度的符号是“M”。它也被称为摩尔浓度,通常用于稀溶液中,这意味着溶质浓度相对于溶剂来说相对较低。 摩尔浓度和摩尔之间的转换很简单,这使得摩尔浓度成为最有优势的浓度单位之一。这是因为溶液的体积以升为单位,这是大多数人熟悉的测量单位。此外,溶液中存在的溶质以摩尔为单位,与摩尔浓度成正比。因此,如果溶质浓度从一摩尔加倍到两摩尔,溶液的摩尔浓度也会加倍。  在实验室中,摩尔浓度经常用于配制溶液。许多化学反应需要特定浓度的反应物才能有效进行。使用摩尔浓度,科学家和研究人员可以通过连续稀释技术轻松配制特定浓度的溶液。这涉及到用溶剂稀释浓溶液以达到所需的摩尔浓度。 摩尔浓度也用于生物化学中,以测量溶液中酶和其他生物分子的浓度,这是该概念的另一个重要应用。酶是加速化学反应的生物催化剂,它们的活性通常通过确定底物转化为产物的速率来衡量。酶的活性取决于溶液中酶的浓度,可以通过测量酶的摩尔浓度来确定。 化学中的摩尔浓度到底是什么?摩尔浓度是给定溶液每升溶质总摩尔数。此外,它也拼写为“molar”。它用字母“M”表示,单位表示为 mol/L、mol/dm^3 或 mol/m^3。对于一升溶液溶解一摩尔溶质,则该溶液的摩尔浓度为一摩尔。溶液的体积由其体积决定,而不是溶剂的量。摩尔浓度的一个缺点是,由于热膨胀,大多数溶液的体积随温度有微小的变化。因此,摩尔浓度有时才用于热力学。  摩尔浓度单位在国际单位制(SI)中,mol/m^3 是摩尔浓度或摩尔浓度的相干单位。然而,这对于大多数实验室应用来说并不方便,大多数化学文献通常使用 mol/dm^3。这相当于 mol/L。这个传统单位经常用字母 M 表示,必要时使用 SI 前缀“mega”来表示亚倍数。例如 mol/m^3 = 10^?3 mol/dm^3 = 10^?3 mol/L = 10^?3 M = 1 mM = 1 mmol/L。 毫摩尔和微摩尔分别表示 mM (10^-3 mol/L) 和 ?M (10^-6 mol/L)。 摩尔浓度公式根据定义,溶液的摩尔浓度定义为在给定体积的溶液中存在的溶质总摩尔数。 因此,摩尔浓度的公式描述如下M=n/V 其中,M 表示溶液的摩尔浓度,n 表示溶质的摩尔数,V 表示溶液的体积(以升为单位)。 因此,它将公式建立如下 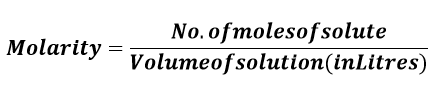 已解决的示例考虑由 15 克硫酸钠组成的混合物。溶液体积为 125 毫升。需要确定指定硫酸钠溶液的摩尔浓度。 解决方案硫酸钠的化学名称是 Na2SO4,水的分子式是 H2O。因此,硫酸钠的分子量可以计算如下 M= 23×2+32+16×4= 142 现在,可以使用以下公式计算解决问题所需的硫酸钠摩尔数 N = 质量(克)/ 分子量 因此, N =15/ 142= 0.106 考虑到这一点,溶液的体积为 125 毫升(如已给定)。当上述数字以升为单位表示时,如下所示 体积 = 125/ 1000 = 0.125 L 现在,我们使用以下公式确定给定溶液的摩尔浓度 摩尔浓度= 溶质摩尔数/ 溶液体积(升) 将数值代入上述公式,我们得到如下摩尔浓度 摩尔浓度 = 0.016/ 0.125,结果为 0.85 mol/L。 因此,溶液的摩尔浓度为 0.85 M 或 0.85 mol/L。 结论总之,摩尔浓度是化学中广泛使用的浓度单位,易于理解和使用。它在分析化学和生物化学中尤为重要,用于配制特定浓度的溶液以及测量酶和其他生物分子的浓度。理解摩尔浓度的概念对于科学家和研究人员准确解释实验结果和做出明智的决策至关重要。 下一主题非语言沟通定义 |
我们请求您订阅我们的新闻通讯以获取最新更新。