解决方案定义17 Mar 2025 | 6 分钟阅读 引言溶液是由两种或两种以上组分组成的特定类型的均质混合物,在化学中使用。溶质是已溶解在溶剂中的物质,溶剂是混合物中的另一种组分。如果溶剂与溶质粒子之间的吸引力强于将溶质粒子保持在一起的吸引力,则溶剂粒子会将溶质粒子拉开并包围它们。然后,被固体溶质包围的溶质粒子会分散到溶液中。在溶液混合的尺度上,化学极性效应会参与其中,从而产生特有的溶剂化相互作用。当溶剂构成混合物的重要部分时,正如通常情况一样,溶液通常具有溶剂的性质。一个重要的参数是溶液的浓度,它衡量在一定体积的溶液或溶剂中存在多少溶质。当水是溶剂之一时,就使用“水溶液”这个术语。  溶液的特征
溶液的类型当混合物是均质的时,其组成部分结合在一起形成一个相。术语“非均质”指的是一种混合物,其组成部分是不同的相。混合物的特性(如温度、浓度和密度)可能均匀地分布在整个体积中,但这仅在没有扩散过程或扩散过程结束后才发生。通常认为数量最多的组分是溶剂。固体、液体或气体都可以是溶剂。溶质是溶液中除溶剂以外的任何一个或多个元素。溶剂和溶液处于相同的物理状态。 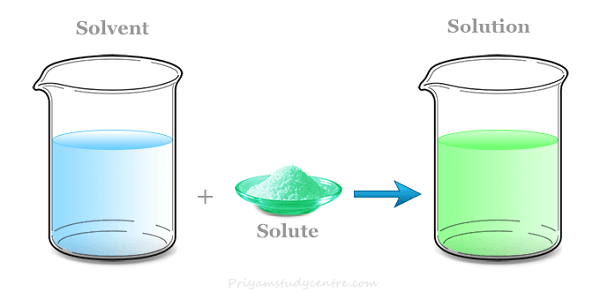 气态混合物在特定条件下,气态溶剂中只溶解了气体(不可冷凝)或蒸气(可冷凝)。空气,其中含有氮气和其他溶解的气体,是气态溶液的一个例子。不可冷凝气体会形成非常简单的溶液,因为气体分子之间的相互作用基本上无关紧要。在文献中,它们仅仅被称为气体的均质混合物,甚至不被归类为溶液。气体系统的均质性通过布朗运动和气体分子的恒定分子扰动得到保证。与可冷凝气体混合物不同,不可冷凝气体混合物(如空气/CO2或空气)不能自然地分离成离散的层状,这表明了相对密度。在典型的地球条件下,扩散力有效地抵消了重力。相反,在可冷凝蒸气的情况下,一旦达到特定温度下的饱和蒸气压,过量的蒸气就会冷凝成液体。  液态溶液如果溶剂是液体,几乎所有固体、气体和液体都可以溶解。以下是一些例子: 1. 气液混合 二氧化碳在水中的例子不太简单,因为除了溶解之外,还会发生化学反应(产生离子)。溶解的气体本身是不可见的,因为它是在分子水平上溶解的;碳酸水中的可见气泡实际上是二氧化碳气体从溶液中逸出的泡腾现象。 2. 液液混合 通过将具有相同化学反应但浓度不同的两种或多种化合物结合起来形成恒定。 (溶液均质化) 酒精饮料基本上是乙醇在水中的溶液。 3. 固液混合
 固态溶液如果溶剂是固体,气体、液体和固体都可以溶解。
溶解度溶解度是指一种物质溶解在另一种物质中的能力。当一种液体可以完全溶解另一种液体时,这两种液体被称为可混溶的。当两种物质永远不能结合形成溶液时,它们被称为不溶的。 所有溶液都具有正的混合熵。分子或离子之间相互作用可能存在也可能不存在能量偏好。如果相互作用是不利的,自由能会随着溶质浓度的增加而降低。当不能溶解更多的溶质粒子时,溶液就被认为是饱和的,因为能量损失最终超过了熵增。然而,根据许多环境因素,如温度、压力和污染,溶液可能饱和的点可能会有很大差异。对于某些溶质和溶剂的混合物,可以通过首先增加溶解度来溶解更多的溶质(例如,通过提高温度),然后再降低它(例如,通过冷却)来制备过饱和溶液。 通常,在给定温度下,溶剂可以溶解更多的特定固体溶质。然而,大多数气体和某些化学品的溶解度显示出随温度下降而下降。溶液的放热焓是导致这种行为的原因。一些表面活性剂表现出这种行为。与固体或气体相比,液体在其他液体中的溶解度通常对温度的敏感性较低。 性质当引入新化合物时,化合物的物理特性(如熔点和沸点)会发生变化。依稀特性共同描述了它们。一种化学物质在其他物质中溶解的量称为浓度,可以用多种方法测量。摩尔浓度、体积百分比和摩尔百分比是其中的一些例子。 液态溶液的特征理论上,流体稀有气体、熔融金属、熔融盐、熔融共价网络和分子液体都可以作为溶剂。化学和生物化学中使用的大多数溶剂是分子液体。根据其分子是否具有持久的电偶极矩,它们可分为极性和非极性两类。质性溶剂和非质性溶剂之间的另一个区别是它们的分子是否能够形成氢键。最流行的溶剂水是极性的,并且可以支持氢键。 由于水分子可以形成氢键并且是极性的,因此它们是出色的溶剂。 在极性溶剂中,盐溶解,产生正负离子,它们被吸引到溶剂分子相反的两端。当水是溶剂时,水合作用发生在溶质的带电离子被水分子包围时。水溶液是常见的例子。这些溶液是电解质。当盐溶解在水中时,必须考虑离子缔合。 当极性溶质溶解在极性溶剂中时,会形成极性键或氢键。例如,乙醇是水溶液,存在于所有酒精饮料中。相比之下,非极性溶剂有助于非极性溶质更好地溶解。例如,碳氢化合物(如石油和油脂)易于混合,但与水不相容。 从受损的船只泄漏的油不会溶解在海水里,而是漂浮在海面上,这表明水和油是不相溶的。 结论在本文中,我们了解了什么是溶液、它的定义以及它的各种类型。它是一种均质混合物,其中溶质溶解在溶剂中。 下一个主题孢子形成定义 |
我们请求您订阅我们的新闻通讯以获取最新更新。